“阿尔法折叠”精准预测蛋白质三维结构 为探索药物分子提供强大工具
2020-12-02 09:46:55 来源: 科技日报
人工智能(AI)再度发威,攻克了生物学领域一项重大难题:预测蛋白质如何从线性氨基酸链卷曲成3D形状以执行任务。据美国《科学》杂志网站11月30日报道,“蛋白质结构预测关键评估”(CASP)竞赛传来喜讯:英国“深度学习”(DeepMind)称其AI实现了上述成就,他们的方法将极大加快新药研发进程。
人体拥有成千上万种不同的蛋白质,每一种蛋白质都包含几十到几百种氨基酸,这些氨基酸的顺序决定了它们之间的作用,赋予蛋白质复杂的三维形状,进而决定了蛋白质的功能。了解这些三维形状有助于研究人员设计出能在蛋白质缝隙内滞留的药物。此外,合成出拥有所需结构的蛋白质,还可以加快酶的研制进程,让生物燃料领域受益。
几十年来,研究人员利用X射线晶体学或低温电子显微镜(cryo-EM)等实验技术来破译蛋白质的三维结构,但这种方法可能需要数月甚至数年,且未必见效。目前,在生命体内发现的2亿多个蛋白质中,只有17万个蛋白质的结构被破解。
1994年,为更好预测和破解蛋白质三维结构,马里兰大学结构生物学家约翰·穆尔特等人发起了CASP竞赛,每两年举行一次。在今年的比赛中,“深度学习”团队的“阿尔法折叠”(AlphaFold)方法的中位分数为92.4(满分100分,90分以上被认为预测方法可与实验方法相媲美),预测最具挑战性的蛋白质的平均得分为87,比次优预测高出25分。它甚至擅长预测嵌入细胞膜的蛋白质结构——细胞膜是许多人类疾病的核心,但很难用X射线晶体学研究。
欧洲生物信息学研究所名誉主任珍妮特·桑顿说:“‘深度学习’团队所取得的成就是惊人的,将改变结构生物学和蛋白质研究的未来。”
穆尔特则表示,这是一个有50年历史的问题,“阿尔法折叠”改变了游戏规则,实验学家将能使用精确的结构预测来理解不透明的X射线和低温电磁数据;药物设计者也可借此迅速厘清新冠病毒等新冒出的危险病原体中每种蛋白质的结构,从而更快研制出相关药物。(记者刘霞)
总编辑圈点
蛋白质的形状决定了其功能。知道蛋白质如何折叠时,我们才能知晓蛋白质的作用。但光是解析蛋白质折叠后的结构,就已经非常困难。常用的方法是冷冻电镜、核磁共振或者X射线等。结构要看得精细,耗时长且成本不菲。预测蛋白质折叠后的形状,则是“地狱难度”。它可以在极短时间内把自己折叠成令人难以想象的形状,预测所需要的算力可谓惊人。在人工智能帮助下,曾经的天方夜谭成为事实。这或许是一项革命性成果,为人类探索药物分子世界提供了强大工具。
为您推荐
精彩放送
热门文章
-

看好拉美业务中长期增长前景 安信国际将伟禄目标价调至18.5港元
-

陆金所控股一季度净利润同比增6.5% 八成新增借款流向小微企业
-

深圳共享单车市场或将重塑 暂不发展互联网租赁电动自行车
-

高管撑股价13家上市银行获增持 后续走势值得期待
-

A股退市名单再添两家 年内退市公司增至25家
-

年内可转债募资超千亿元 募资规模略低于去年同期
-

北交所首家转板公司诞生!观典防务在科创板上市
-

南京银行第4次被股东增持 城商行为何受“青睐”?
-

多家中小银行下调存款利率 存款降息潮是否来临?
-
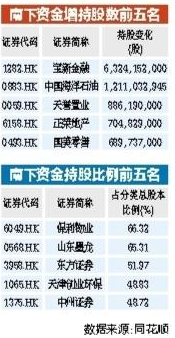
南下资金持续流入港股 年内增持中海油等43只港股逾亿股
-

降息“靴子”落地!深圳银行均已执行最新LPR报价
-

韦尔股份增持北京君正 增持后累计持有不超过5000万股
精彩图片
-

迄今最具破坏力小行星将掠过地球 飞行速度比高速飞行子弹快20倍
-

全球变暖影响人们睡眠时间 每年平均失去44小时睡眠时长
-

“下一代奇迹材料”石墨炔首创成功 填补碳材料科学空白
-

早期动物五亿多年前已形成复杂生态群落 为寒武纪大爆发奠定基础
-

西藏察隅发现中国最高树 高达83.2米胸径207厘米
-

揭示月背月壤粗细规律!月球表面年龄与月壤内部非均匀性呈正相关
-

长期暴露于野火中的居住人群 脑瘤发病率提高10%
-

研究发现:海草底部蔗糖浓度约比记录高80倍
-

4月苍穹精彩纷呈 群星“成团出道”
-

科学家发现新方法 提高鹿角珊瑚种植成功率
-

湖南首创数字贸易综合服务平台 1.2万家企业入驻
-

研究:每周吃5次或更少的肉与较低的总体癌症风险相关
热文
-

美巢专注家装环保辅料领域,致力于打造室内完美墙面
-

中视酒业供应链十大解决方案突破行业痛点多方共赢!
-

沈腾、马丽今晚做客“蘑菇屋“ 容声冰箱为新鲜美食保驾护航
-
资管机构遭仿冒,hopingclub华英会紧急澄清,请投资者提高警惕
-

QCY AilyPods蓝牙耳机预售10分钟破千台:够小够轻够性价比!
-

坚果投影仪O1和峰米R1 Nano,居家观影必备!
-
轻燃卡卡:轻体健康领域品牌林立,轻燃卡卡凭什么破圈出局?
-

数据表明母婴的风口要来了 选择靠谱的品牌是关键
-
郑明明抗皱凝时胶囊精华有效吗?要怎么用呢?
-

青海省商业性住房贷款利率下调 首套房贷利率调整为4.8%
-

太原多家楼盘已按房贷利率新标办贷 太原市民购房能省多少钱?
-

前5月兰州新区商品房销售面积环比增长约12% 价格同比增2.75%
-

5.26苏州楼市成交稳定 住宅房源共成交34367.37㎡
-

高管撑股价13家上市银行获增持 后续走势值得期待
-

A股退市名单再添两家 年内退市公司增至25家
-

银保监会拟全方位透视险企综合风险水平 全新划分风险等级
-

年内可转债募资超千亿元 募资规模略低于去年同期
-

前四月发放就业补贴超亿元 惠及高校毕业生3.8万人次
-

618选机困难症?一文读懂iQOO Neo6 SE、红米 Note 11T Pro怎么选
-

2022冰箱高峰论坛成功举办,海信真空冰箱获权威肯定
-

股票哪些技术指标最有用?如何设置股票技术指标参数?
-

深港通的标的股有哪些? 什么股票属于深港通?
-
95开头的电话能接不?9521是什么电话?
-

上折和下折什么意思? 现货折盘价是什么意思?
-

余额宝双休日也有收益吗? 零钱通周末有收益吗?
-

深发展信用卡怎么样?信用卡申请进度查询方法是什么?
-

余额宝转出10万要多久?余额宝实时到账吗?
-

乐蜂网创建时间是什么时候?乐蜂网还存在吗?
-

信用卡积分兑换订单怎么查询?5000积分兑换多少话费?
-

国美电器是做什么的董事长是谁?国美有哪些股票代码?
-
腾讯持有快手多少股票?快手与腾讯是什么关系?
-

余额宝一万块钱一天收益多少?余额宝可以当日提现吗?
-
中欧基金刘建平:优化机制和文化 提升专业能力 切实保护投资者利益
-

稻香村集团(山东公司)一行到访山东朱氏药业集团参观交流
-
蓝湾壳寡糖和壳寡糖益生菌 为您保肝护菌
-

品效双赢,“抖音520宠爱季”引领行业加倍“宠爱”
-

朱氏药业集团朱坤福:把握爆品时代机遇、迈进品牌时代新征程
-
招行信用卡借势金融科技,为客户创造更多价值
-

高新科技培育钻石,或掀时尚界新热潮
-

连续四年!用友精智成为国家级跨行业跨领域工业互联网平台
-

北交所首家转板公司诞生!观典防务在科创板上市
-

hoping club华英会成功的十个法则
-

618购游戏神机iQOO Neo6超优惠,至高24期免息+全程价保+保值换新
-

2022年新形象!AMIRO品牌全新视觉升级!
-

贵州酱酒集团“启航”,助力贵州白酒产业产业升级、产区发展
-

赛克斯发布2022年英国度假屋出租市场展望报告
-

江山欧派以动求变,实现逆势增长,2021年营收增4.84%
-

焕白新篇章,伊肤泉美白祛斑,暗沉肌再回白嫩态
-

魅力舞台 倾情演绎:宜宾天立学校举办第六届戏剧节
-

重磅发布!全景求是荣获“2021年度最佳人力资源服务机构”
